Trong bài viết dưới đây, điện máy Sharp Việt Nam sẽ chia sẻ định nghĩa số mol, nồng độ mol và công thức tính nồng độ mol, công thức tính số mol hay công thức tính nồng độ phần trăm giúp bạn có thêm kiến thức về hóa học để có thể giải các bài toán liên quan đến nồng độ mol hay thể tích dễ dàng nhé Hãy tham khảo với Mobitool nhé.
Contents
Video nồng độ mol
Số mol là gì?
Số mol hay mole (ký hiệu: mol) là đơn vị đo lường dùng trong hóa học nhằm diễn tả lượng chất có chứa xấp xỉ 6,022.1023 số hạt đơn vị nguyên tử hoặc phân tử chất đó. Mol là một đơn vị SI, với ký hiệu đơn vị mol.

Công thức tính số mol
1. Cách tính số mol qua khối lượng
Khi biết được khối lượng của một chất ta sẽ tính số mol theo cách sau:
n = m/M
Trong đó:
- n là số mol, đơn vị là mol
- m là khối lượng, đơn vị là gam
- M là khối lượng mol chất, đơn vị là g/mol
2. Cách tính số mol qua thể tích
Nếu biết được thể tích của một chất, ta có số mol của chất đó:
n = V/22,4
Trong đó:
- n là số mol chất khí ở ở diều kiện tiêu chuẩn, đơn vị tính là mol
- V là thể tích khí, đơn vị tính là lit
Còn nếu ở điều kiện thường, số mol của một chất được tính như sau:
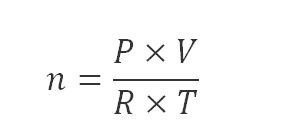
-Trong đó:
- n là số mol chất khí ở ở diều kiện thường, đơn vị tính là mol
- P là áp suất , đơn vị tính là atm
- V là thể tích khí, , đơn vị tính là lit
- R là hằng số = 0.082
- T là nhiệt độ = 273 + t (K)
3. Tính số mol theo số nguyên tử, phân tử
n = A/N
Trong đó:
- A: số nguyên tử hoặc phân tử
- N: số Avogadro = 6.1023
- n: số mol (mol)
Các dạng bài tập về công thức tính mol
Ví dụ 1: Tính số mol nguyên tử hoặc phân tử trong các lượng chất sau: 1,44.1023 phân tử HCl
Lời giải:
Số mol phân tử HCl là:
Ví dụ 2: Tính số mol nguyên tử hoặc số mol phân tử có trong những lượng chất sau:
a) 1,8.1023 nguyên tử Fe
b) 20 gam NaOH
c) 6,72 lít khí H2 (đktc)
Lời giải
a) Số mol nguyên tử có trong 1,8.1023 nguyên tử Fe là:

Ví dụ 3: Tính số mol của những lượng chất sau:
a) 4,6 gam Na; 8,4 gam KOH; 11,76 gam H3PO4; 16 gam Fe2O3
b) 2,24 lít khí C2H4; 3,36 lít khí CO2, 10,08 lít khí N2. Các thể tích đo ở đktc.
Lời giải

Xem thêm:
- 10 phương pháp cân bằng phương trình hóa học có ví dụ minh họa
- Công thức tính hiệu điện thế chi tiết từ A – Z
- Công thức tính hiệu suất phản ứng hóa học, vật lý đầy đủ từ A – Z [Ví dụ]
Nồng độ mol là gì?
Nồng độ mol chính là số mol chất tan trong 1 lít dung dịch. kí hiệu là CM
Công thức tính nồng độ mol
– Nồng độ mol của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch
CM = n/Vdd
Trong đó:
- CM là nồng độ mol
- n là số mol chất tan
- Vdd là thể tích dung dịch (lít)
Ví dụ 1: Tính nồng độ mol của dung dịch khi 0,5 lit dung dịch CuSO4 chứa 100 gam CuSO4
Hướng dẫn giải:
Số mol của CuSO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch CuSO4 = 0,625 : 0,5 = 1,25M
Ví dụ 2: Tính nồng độ mol của dung dịch khi hòa tan 15,8g KMnO4 trong 5 lít nước.
Lời giải:
Số mol của KMnO4 là: nKMnO4 = 15,8/158 =0,1 (mol)
Nồng độ mol của dung dịch: CM = 0,1/5 =0,02M
Ví dụ 3: Tính khối lượng chất tan có trong 600ml dung dịch CuSO4 có nồng độ mol là 1,5M
Lời giải:
Ta có V = 500 ml = 0,5 lít
Áp dụng công thức CM = n/V => nCuSO4 = V x CM = 0,5 x 1,2 =0,6 (mol)
Khối lượng Đồng sunfat CuSO4: nCuSO4 x MCuSO4 = 0,6 x 160 = 96 (g)
Công thức tính nồng độ phần trăm
C% = (mct/mdd) x 100%
– Trong đó:
- mct: khối lượng chất tan
- mdd: Khối lượng dung dịch, mdd = mdm + mct
– Ví dụ 1: Tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước chúng ta thu được dung dịch B có nồng độ bao nhiêu?
Lời giải:
Ta có phương trình phản ứng hóa học sau
2K + 2H2O —-> 2KOH + H2
Số mol của K = 3,9/ 39 = 0,1 => mol KOH = 0,1 => mol H2O = 0,05
Theo cân bằng phương trình ta tính được:
mdd = mk + mH2O – mH2 = 3,9 + 36,2 – (0,05.2) = 40 gam
=> Áp dụng công thức C% = (mct/mdd).100% ta có C% = [(0,1.56)/40].100% = 14%
Kết luận: Khi tiến hành hòa tan 3,9 gam Kali vào 36,2 gam nước ra sẽ thu được dung dịch có nồng độ 14%.
Ví dụ 2: Tiến hành hòa tan 20 gam muối vào nước thu được dung dịch A có C% = 10%
a, Hãy tính khối lượng của dung dịch A thu được
b, Hãy ính khối lượng nước cần thiết cho sự pha chế
Lời giải:
a, Áp dụng công thức C% = (mct/mdd).100% ta có:
mdd=(mmuối.100)/ C% = (20.100)/10 = 200 gam
Kết luận: Vậy khối lượng dung dịch A là 200 gam
b, Áp dụng phương pháp bảo toàn khối lượng ta có mnước=mdd – mmuối = 200 – 20 = 180 gam
Kết luận: Vậy để có thể hoàn tan 20 gam muối thì chúng ta phải cần 180 gam nước để tạo ra 200 gam dung dịch
Với những thông tin mà chúng tôi vừa chia sẻ có thể giúp bạn giải được các bài toán về hóa học đơn giản nhé. Chúc các bạn thành công!
